概述:脊髓損傷(SCI)具有高致殘率和高死亡率的發病特點,是一種對患者生理和心理都具有高度破壞性的疾病,目前仍缺乏有效的治療方法。脊髓損傷后,缺血、外周炎癥細胞浸潤、氧化應激等一系列繼發性損傷反應形成了不利于神經恢復的微環境,最終導致神經元和膠質細胞凋亡和壞死。
近年來,間充質干細胞(MSC)移植成為一種更有前景的治療方法。間充質干細胞可通過免疫調節、神經保護、神經再生等多種機制促進脊髓損傷修復,給脊髓損傷患者帶來希望。本文探討了間充質干細胞治療脊髓損傷方法中的神經保護和神經再生部分。
間充質干細胞移植:脊髓損傷后的神經保護和神經再生
介紹
脊髓損傷 (SCI) 是一種毀滅性的神經系統疾病,可導致運動、感覺和自主神經功能暫時或永久性損傷。據估計,過去30年來,全球SCI患病率不斷增加,不同國家每百萬人中有236至1298名患者。每一位SCI患者都承受著身心的雙重折磨,還面臨著經濟困難、人際關系破裂等困難。
SCI的發病機制可分為兩個階段,第一階段的損傷為原發性損傷(如跌倒、交通事故等),繼發性損傷為繼發性損傷作為一系列復雜的異常分子信號傳導、炎癥細胞浸潤、炎癥因子釋放、氧化應激、血管變化和繼發性細胞功能障礙分層關聯反應,最終導致神經元和膠質細胞凋亡壞死,形成微環境不利于神經再生和損傷恢復的微環境,加重損傷,當損傷進入繼發性損傷的慢性期時,已經形成的膠質疤痕會阻礙神經再生。SCI患者由于原發性損傷和后續損傷,會出現受傷脊髓水平以下的感覺喪失和功能缺陷,這會影響病情的嚴重程度。
迄今為止,尚無任何治療方法能夠正確治療SCI并改善SCI患者的預后。甲基強的松龍除了能有效治療 SCI 后神經炎癥外,還可降低氧化應激并抑制脂質過氧化。然而,使用甲潑尼龍會導致嚴重的副作用,如敗血癥、肺炎、傷口感染和消化道出血。神經元膜中發現的糖脂分子神經節苷脂被用作治療SCI的神經保護劑,具有多種作用,包括預防細胞凋亡和抗興奮性毒性活性。但研究表明,神經節苷脂治療六個月后,神經功能恢復沒有差異。

間充質干細胞移植治療脊髓損傷的前景
間充質干細胞 (MSC)具有多能性干細胞可源自多種組織,包括骨髓、脂肪、人臍帶血等。間充質干細胞具有多向分化和自我更新能力,可分化為終末期細胞細胞細胞、軟骨形成細胞細胞和神經元細胞在體外受到各種刺激因子和誘導培養基的影響。這些品質使得間充質干細胞在近幾十年來逐漸在醫學和組織工程領域受到關注,現在大量的實驗已經證明間充質干細胞是一種非常有前途的材料。間充質干細胞(MSC)移植,是一種充滿樂觀和發展潛力的新型療法,正是因為目前可用的抑制神經炎癥和神經保護藥物未達到最佳標準而發展起來。
大量研究證明不同來源(骨髓、脂肪、臍帶血、牙髓等)的間充質干細胞具有治療脊髓損傷的能力,這與類似的機制是一致的(圖1)。
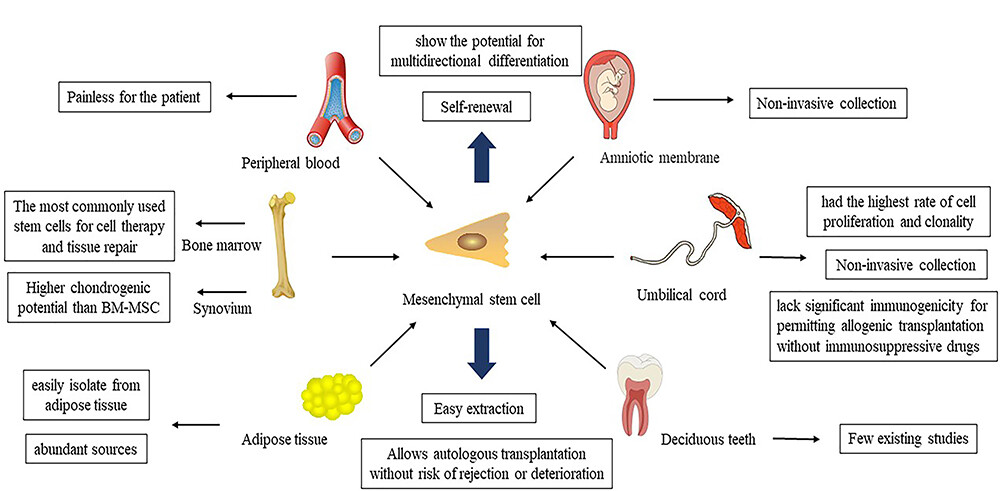
許多間充質干細胞移植臨床試驗已處于第一階段(I/II期),其可行性和安全性已初步確定。我們將討論間充質干細胞治療脊髓損傷的機制,重點關注神經保護作用間質干 細胞移植的機制和神經再生機制,以便更好地了解并簡化后續研究。
脊髓損傷的病理生理學
脊髓損傷(SCI)的第一階段是原發性損傷事件,也稱為原發性損傷,是脊髓因壓縮、剪切、撕裂、急性拉伸/牽拉和大面積沖擊等物理力而受到的損傷。此階段受傷部位的血管破裂、滲漏,也會導致神經實質和膠質結構的損傷。
繼發性損傷是脊髓損傷 (SCI) 的第二階段,由原發性損傷事件引發,引發幾乎持續整個持續時間的繼發反應SCI.繼發性損傷事件還通過一系列復雜且相關的級聯反應,導致脊髓損傷區域不斷生長,加重SCI (圖2)。

(B) 正常脊髓組織。 (C) 脊髓損傷時,神經實質和神經膠質結構受損,中性粒細胞、巨噬細胞/小膠質細胞、淋巴細胞等浸潤損傷部位面積,加重脊髓損傷的化合物(炎性細胞因子、活性氧、組??織降解酶等)濃度升高。 (D) 膠質疤痕的形成。
根據各損傷時期的獨特特點,繼發損傷發生分為急性、亞急性和慢性三類。受傷后,急性期持續48小時,其特征是血管功能障礙、自由基生成、鈣內流增加、炎癥、興奮性毒性和神經毒性等癥狀。脊髓損傷如果不中斷急性期,病程進入亞急性期(2-14天),表現為軸突脫髓鞘、華勒變性、軸突變性等。重塑和其他癥狀。隨后進入慢性期,并持續到個體的余生,慢性期的特點是囊性空腔形成、軸突枯萎、神經膠質增生和細胞外基質形成后的疤痕形成基質沉積。
隨著脊髓損傷的進展,病變會生長并形成囊腫,留下殘留的壞死或凋亡細胞的微囊腔細胞 a>最終形成脊髓空洞,造成永久性傷害。
間充質干細胞移植
干細胞療法已成為脊髓損傷的前沿治療方法,一些早期臨床試驗表明,細胞移植通常是可行的。在眾多替代細胞中,干細胞因其自我更新和多向分化的能力而備受關注,其次是選擇不同的干細胞,間充質干細胞(MSCs)的特點是易分離、易保存、增殖快、免疫原性低、不涉及倫理問題。
目前,局部注射、靜脈注射和鞘內注射是直接注射間充質干細胞治療脊髓損傷最常用的三種方法。雖然鞘內和靜脈注射侵入性較小,但需要大量細胞 ,到達損傷部位的間充質干細胞細胞比例較低。
局部注射可將足量干細胞直接移植到脊髓損傷部位,但可能進一步損傷脊髓,并增加傷口感染風險。在鞘內注射和靜脈注射的實驗中,間充質干細胞的 “歸巢 “能力引起了人們的興趣。血管內皮生長因子-A(VEGF-A)可刺激血小板衍生生長因子受體(PDGFRs),從而調節人骨髓間充質干細胞的遷移。損傷部位釋放的生長因子(PDGF或IGF-1)可吸引間充質干細胞歸巢,損傷部位炎癥因子或趨化因子的增加也會促進這種細胞行為。然而,通過 “歸巢 “移動的間充質干細胞可能會出現細胞定位失敗。這可能與注射時間、劑量等有關。要確定準確的 “歸巢 “機制和變量之間的關系,還需要進一步的研究。
旁分泌和定向分化是間充質干細胞修復損傷組織的兩大關鍵功能,但在脊髓損傷模型中,旁分泌比定向分化更容易發生。間充質干細胞具有分化潛能,可在體外刺激分化成神經元細胞。為替代死亡細胞并恢復神經元傳導通路的完整性,研究人員嘗試將間充質干細胞移植到脊髓病變部位后,使其發育成神經元細胞和神經膠質細胞。然而,最近的研究表明,目前仍缺乏區分的證據。
現有研究表明,移植的間充質干細胞可能主要通過細胞間相互作用和旁分泌效應發揮神經保護和神經再生作用,支持脊髓損傷后的形態和功能恢復。根據對脊髓損傷動物模型的研究,接受間充質干細胞移植治療的脊髓損傷小鼠或脊髓損傷大鼠的運動和感覺能力有所改善,并促進了后肢功能的恢復。現有數據已向研究人員證明,間充質干細胞移植治療脊髓損傷是有效的,即使在臨床試驗中遇到了少數脊髓損傷患者出現不良反應(頭痛、尿路感染、惡心和嘔吐)以及患者人數少且不均等的挑戰。
間充質干細胞治療脊髓損傷:神經保護
神經保護是指通過減輕和減弱繼發性損傷中的特定事件,保護損傷部位及周圍神經元的結構和功能免受進一步損傷,以降低損傷發生率、減輕損傷程度。在脊髓損傷的急性和亞急性期,神經保護是至關重要的治療目標,也是應盡快落實的第一道防線。根據次級級聯反應中的不同事件,抗炎、抗氧化、抗凋亡、抗興奮性毒性和通道阻斷可以作為神經保護的突破點。
隨著研究進展,間充質干細胞對脊髓損傷的治療作用越來越受到關注,因為它們表現出顯著的自分泌和旁分泌活性,發揮抗炎和抗氧化作用,預防神經退行性變和細胞凋亡,促進軸突和髓磷脂再生,防止血管損傷,增強血管生成(圖3)。
圖3:間充質干細胞具有抗炎作用(促進M2巨噬細胞的極化,減少IL-7、IFN-和TNF-等促炎因子的表達,并增加抗炎因子如IL-4和IL-13的表達;抗氧化劑(清除自由基、增強宿主抗氧化防御、改變細胞生物能學);抗凋亡(分泌各種保護因子、降低caspase-9和caspase-3蛋白水平等);促進血運重建(各種生長因子的分泌,修復新生血管的密度增加)。
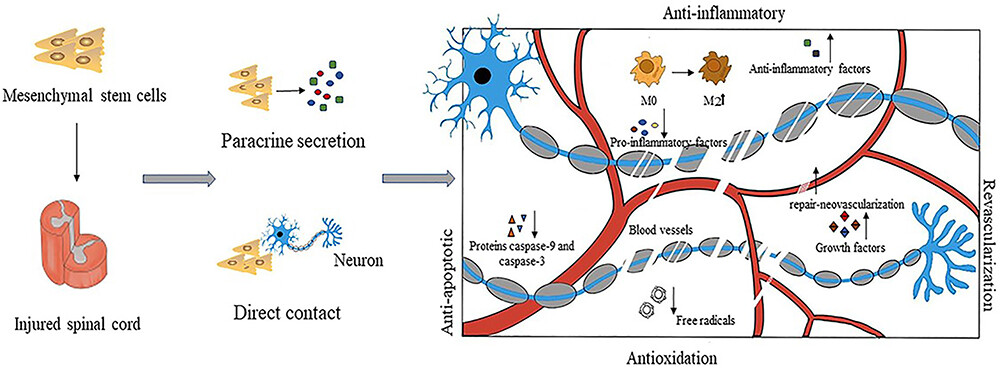
間充質干細胞治療脊髓損傷:神經再生
在脊髓損傷的急性和亞急性階段,及時的神經保護可能非常有益。然而,對于慢性期患者來說,神經再生比神經保護更重要。促進損傷后軸突再生是治療脊髓損傷慢性期的一個關鍵目標,因為中樞神經聯系的破壞是持續功能障礙的原因之一SCI之后。脊髓損傷患者的功能恢復可能會顯著改善,即使是少量的軸突再生。
軸突延長、軸突萌芽和新軸突生長、神經細胞髓鞘再生以及損傷后受損神經組織(神經元、軸突、突觸和神經膠質細胞)再生和修復的其他過程都是神經再生的例子。
基于間充質干細胞的再生療法的早期研究集中于它們在移植后分化為神經元或神經膠質細胞的能力。然而,目前缺乏MSC體內分化確鑿的實驗證據。盡管如此,移植的間充質干細胞仍然能夠執行多種任務,例如提供營養支持、調節急性期的炎癥反應以及降低疤痕組織抑制等。亞急性和慢性階段創造有利于軸突再生的環境。神經營養因子已被證明可增強CNS神經元損傷后的生長潛力,神經營養因子(BDNF)或膠質源性神經營養因子暴露后神經元的能力增強(GDNF) 克服非許可環境是由細胞內cAMP水平升高介導的。MSCs能夠分泌腦源性生長因子(BDNF)、膠質細胞源性生長因子(GDNF)、神經生長因子(NGF)、NT-1、 NT-3、CNTF和堿性成纖維細胞生長因子 (bFGF),由此推測移植的MSC可能通過分泌神經營養因子來增強受損神經元的內在生長傾向。
除了改善內在生長傾向外,神經營養物質還可以充當抗氧化劑、抗炎劑,幫助改善現有的不良環境,而 BDNF可以對抗氧化應激,從而提高生長能力。移植間充質干細胞后星形膠質細胞產生的神經膠質疤痕也可能被改變。根據研究,將間充質干細胞移植到SCI大鼠體內可以防止神經膠質疤痕的產生,并改變反應性星形膠質細胞的形狀,這兩者結合為軸突再生創造了理想的微環境。
結論
脊髓損傷(SCI)是一種嚴重、長期且不可逆的損傷。因此,醫學領域的大量學者和專業人士渴望找到安全有效的脊髓損傷治療方法。大量臨床前和臨床研究已證明間充質干細胞(MSC)在治療SCI中的有效性。 間充質干細胞治療脊髓損傷的有效性現已通過大量臨床前和臨床研究得到證實。
間充質干細胞移植提供的抗炎、抗氧化、抗細胞凋亡和增加血流量可保護神經。它還可以增加內在的神經元生長潛力,增強非許可環境,并改變神經膠質疤痕以支持再生。由于間充質干細胞移植的治療機制尚不完全清楚,而且由于細胞不準確等問題,未來的研究可能需要進一步探討更具體的治療機制以及更好的間充質干細胞移植方法(預處理、基因修飾和聯合治療等)存在局部化和直接細胞移植后存活率低的問題。
參考資料:Si-Yu Chen, Rui-Lin Yang, Xiang-Chong Wu, De-Zhi Zhao, Sheng-Ping Fu, Feng-Qin Lin, Lin-Yan Li, Li-Mei Yu, Qian Zhang & Tao Zhang (2023) Mesenchymal Stem Cell Transplantation: Neuroprotection and Nerve Regeneration After Spinal Cord Injury, Journal of Inflammation Research, 16:, 4763-4776, DOI: 10.2147/JIR.S428425
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信