對于1型糖尿病患者來說,依賴胰島素注射幾乎是日常生活的一部分,但這種局面或許正在被改寫。近幾年,全球有數(shù)十家研究機(jī)構(gòu)和企業(yè)嘗試借助干細(xì)胞技術(shù)“重啟”胰島β細(xì)胞的功能。
2025年,《Cell》《Nature Biotechnology》《New England Journal of Medicine》等國際權(quán)威期刊先后發(fā)表了相關(guān)研究,結(jié)果都指向一個趨勢:干細(xì)胞療法在1型糖尿病的治療中展現(xiàn)出了前所未有的潛力。
像Vertex制藥公司VX-880療法的最新2期試驗(yàn)顯示,??83%的重癥患者??在單次輸注后完全停用外源性胰島素;中國團(tuán)隊(duì)的自體來源化學(xué)重編程胰島移植患者實(shí)現(xiàn)部分患者在移植后3個月內(nèi)停用胰島素。
這些數(shù)字背后是一個正在形成的共識:干細(xì)胞治療正從實(shí)驗(yàn)室走向臨床。接下來,本文將系統(tǒng)梳理2025年干細(xì)胞療法的最新臨床證據(jù)與關(guān)鍵障礙,深入解析這項(xiàng)“治愈希望”?技術(shù)其距離真正走進(jìn)常規(guī)臨床應(yīng)用,還有多遠(yuǎn)。

2025干細(xì)胞治療1型糖尿病最新進(jìn)展:距離臨床還有多遠(yuǎn)?
1型糖尿病困境與治療局限
1型糖尿病是一種自身免疫性疾病,免疫系統(tǒng)錯誤攻擊并破壞胰島β細(xì)胞,導(dǎo)致胰島素絕對缺乏。患者必須終身依賴外源性胰島素治療,日常管理包括每日4-7次指尖血糖檢測和精確的胰島素劑量調(diào)整。即使采用強(qiáng)化胰島素治療,患者仍面臨血糖波動和嚴(yán)重低血糖風(fēng)險(xiǎn),以及遠(yuǎn)期微血管和大血管并發(fā)癥威脅。
現(xiàn)有治療手段無法根治疾病,只能控制癥狀,患者期待一種能夠解決根本問題的治療方法。這些局限催生了干細(xì)胞療法的發(fā)展,利用干細(xì)胞的自我更新和分化潛能,創(chuàng)造替代性胰島素生成細(xì)胞,從根本上恢復(fù)患者的生理性血糖調(diào)節(jié)能力。
干細(xì)胞治療1型糖尿病的三大作用機(jī)制
干細(xì)胞治療1型糖尿病主要通過以下三大機(jī)制發(fā)揮作用:
1.細(xì)胞替代是最直接的策略:利用干細(xì)胞分化出的胰島β細(xì)胞,來取代已經(jīng)被破壞的細(xì)胞,從而恢復(fù)體內(nèi)的胰島素分泌功能。
2.免疫調(diào)節(jié)作用針對1型糖尿病的自身免疫病因:像間充質(zhì)干細(xì)胞這類細(xì)胞,能夠在一定程度上“安撫”異常活躍的免疫系統(tǒng),保護(hù)仍存活的胰島β細(xì)胞不再遭到持續(xù)破壞。
3.旁分泌效應(yīng)也不可忽視:干細(xì)胞還能釋放多種生物活性分子,幫助改善胰島周圍的微環(huán)境。它們既能促進(jìn)血管新生,增強(qiáng)局部供血,也能減輕炎癥反應(yīng),從而提高移植細(xì)胞的存活率和功能穩(wěn)定性。
2025年干細(xì)胞治療1型糖尿病患者最新臨床進(jìn)展
1.國內(nèi)首個“干細(xì)胞再生胰島”療法獲批,多名1型糖尿病患者移植后3個月內(nèi)停用胰島素
2024年5月7日,上海長征醫(yī)院殷浩教授團(tuán)隊(duì)聯(lián)合中國科學(xué)院程新教授團(tuán)隊(duì)在《細(xì)胞·發(fā)現(xiàn)》(Cell Discovery)發(fā)表重磅研究,通過自體干細(xì)胞再生胰島移植,成功治愈一名患病25年的Ⅱ型糖尿病患者。[1]
時(shí)隔一年,2025年4月18日,殷浩教授團(tuán)隊(duì)再傳捷報(bào):其與中科院分子細(xì)胞科學(xué)卓越創(chuàng)新中心合作開發(fā)的“異體人再生胰島注射液(E-islet 01)”,正式獲得國家藥品監(jiān)督管理局(NMPA)臨床試驗(yàn)?zāi)驹S可。[2]
這是全球第二個、中國首個獲批臨床試驗(yàn)的通用型再生胰島療法,標(biāo)志著我國在糖尿病再生醫(yī)學(xué)領(lǐng)域?qū)崿F(xiàn)了從“跟跑”到“領(lǐng)跑”的跨越。并且殷浩與合作團(tuán)隊(duì)先后利用自體和異體再生胰島移植,成功治愈多例1型糖尿病患者!

殷浩教授介紹,E-islet 01是利用細(xì)胞重編程和定向分化等前沿技術(shù)將健康供體來源的血液細(xì)胞轉(zhuǎn)化為內(nèi)胚層干細(xì)胞,再以內(nèi)胚層干細(xì)胞為原材料定向制備的再生胰島,其具備與健康胰島一致的結(jié)構(gòu)和功能,能夠通過實(shí)時(shí)感知血糖變化精準(zhǔn)分泌包括胰島素、胰高血糖素、生長抑素等一系列內(nèi)分泌激素,從而維持血糖穩(wěn)態(tài)。
長征醫(yī)院的臨床研究(IIT)表明,E-islet 01經(jīng)微創(chuàng)操作輸注到患者肝門靜脈內(nèi),可實(shí)現(xiàn)胰島功能衰竭糖尿病(Ⅰ型和嚴(yán)重Ⅱ型)患者的治愈。
2.人胚干細(xì)胞衍生胰島細(xì)胞療法突破:83%重癥糖尿病患者完全停用胰島素
6月20日,福泰制藥(Vertex)在美國糖尿病協(xié)會(ADA)科學(xué)年會上震撼發(fā)布FORWARD-101臨床試驗(yàn)的1/2/3期的最新研究結(jié)果,并更新了1/2期試驗(yàn)的最新臨床數(shù)據(jù),相關(guān)結(jié)果發(fā)表在國際期刊《新英格蘭醫(yī)學(xué)雜志》上。[3]
該研究聚焦于zimislecel(原名VX-880),一種基于干細(xì)胞的完全分化胰島細(xì)胞療法,旨在治療伴有低血糖意識障礙和嚴(yán)重低血糖事件(SHE)的1型糖尿病(T1D)患者。

在FORWARD-101最新臨床試驗(yàn)中,12名接受單次全劑量Zimislecel輸注的患者接受了至少1年的隨訪,結(jié)果顯示:
所有12名參與者均表現(xiàn)出內(nèi)源性胰島素分泌(通過C肽評估)的恢復(fù),嚴(yán)重低血糖事件的消失,以及血糖控制達(dá)標(biāo)(HbA1c<7%,TIR>70%)。
該療法顯著減少了所有患者的外源胰島素的使用量,平均每位患者都減少了92%,并且在83%(10例)患者中完全消除了外源胰島素的使用需求。
與VX-880使用相關(guān)的不良事件與典型的胰島輸注和現(xiàn)有免疫抑制藥物方案一致,未在任何受試者中觀察到額外的不良癥狀。
試驗(yàn)結(jié)果表明,Zimislecel在1型糖尿病治療中展現(xiàn)出革命性潛力:不僅在1年內(nèi)顯著減少甚至停用外源胰島素(平均減少92%),同時(shí)血糖穩(wěn)定、低血糖風(fēng)險(xiǎn)消失。10人完全擺脫胰島素注射,安全性良好,不良反應(yīng)與常規(guī)治療相當(dāng)。這一突破為糖尿病患者提供了“擺脫每日注射”的新希望,未來或成為治療的重要選擇。
詳情請瀏覽:突破性干細(xì)胞療法Zimislecel:83%重癥糖尿病患者停用胰島素超一年
3.京都大學(xué)完成日本首例iPS細(xì)胞移植治療:初期安全性良好
2025年4月14日,日本京都大學(xué)醫(yī)學(xué)部附屬醫(yī)院發(fā)布了一則重磅消息–?iPS細(xì)胞療法在糖尿病治療領(lǐng)域取得突破性進(jìn)展,有望減輕糖尿病患者每日注射胰島素的負(fù)擔(dān)。
該院宣布成功完成日本首例干細(xì)胞再生胰島組織移植手術(shù),首位接受治療的1型糖尿病患者術(shù)后觀察顯示良好臨床反應(yīng),近期將進(jìn)行第二例移植,這標(biāo)志著人類在攻克糖尿病征程中邁出關(guān)鍵一步。

這項(xiàng)突破性研究植根于2007年山中伸彌教授開創(chuàng)的iPS細(xì)胞技術(shù),該技術(shù)榮獲2012年諾貝爾生理學(xué)或醫(yī)學(xué)獎。
這項(xiàng)成果源自2007年由山中伸彌教授開創(chuàng)的iPS細(xì)胞技術(shù),該技術(shù)曾在2012年獲得諾貝爾生理學(xué)或醫(yī)學(xué)獎。研究團(tuán)隊(duì)利用健康供者的誘導(dǎo)多能干細(xì)胞分化出具備胰島素分泌功能的“胰島細(xì)胞”,再將其制成片狀,移植到患者體內(nèi),以期重建其胰島功能。
京都大學(xué)大學(xué)院醫(yī)學(xué)研究科的矢部大介教授矢部大介教授在新聞發(fā)布會上透露:“首例患者術(shù)后已順利度過關(guān)鍵觀察期,未發(fā)生重大問題,安全性評估最多將持續(xù)5年。若后續(xù)進(jìn)展順利,2030年前有望實(shí)現(xiàn)該技術(shù)的臨床應(yīng)用。”
相關(guān)閱讀:2025年干細(xì)胞治療1型糖尿病最新臨床進(jìn)展,治愈已觸手可及(截至8月)
關(guān)鍵障礙:臨床轉(zhuǎn)化面臨的挑戰(zhàn)
盡管臨床前景光明,但干細(xì)胞療法要成為常規(guī)臨床選擇還需跨越多重障礙。
1.免疫排斥問題是首要挑戰(zhàn):無論是異體還是自體來源,移植細(xì)胞都面臨免疫攻擊。異體細(xì)胞需??終身免疫抑制劑??,增加感染和腫瘤風(fēng)險(xiǎn);自體細(xì)胞雖避免了異體排斥,但仍面臨??自身免疫再度攻擊。這些問題都是要解決的。
2.量產(chǎn)和質(zhì)量控制是產(chǎn)業(yè)化難點(diǎn):GMP級細(xì)胞生產(chǎn)要求高,成本昂貴,當(dāng)前治療成本是胰島素終身費(fèi)用的數(shù)倍。
3.倫理和監(jiān)管框架仍需完善:特別是對于胚胎干細(xì)胞來源的產(chǎn)品,以及基因編輯技術(shù)的應(yīng)用。
干細(xì)胞療法的安全性:不良事件與風(fēng)險(xiǎn)管控
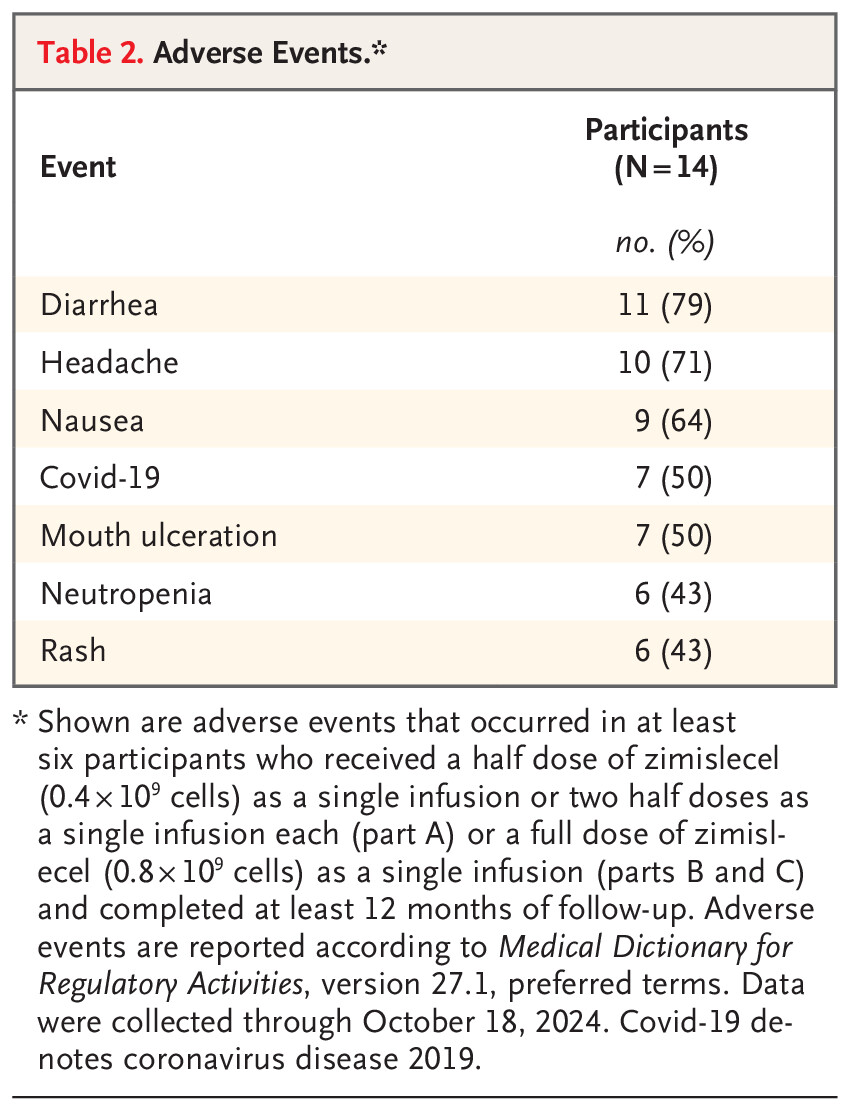
整體來看,干細(xì)胞治療1型糖尿病的安全性表現(xiàn)令人放心。以福泰制藥(Vertex)開展的FORWARD-101臨床試驗(yàn)為例:在完成至少12個月隨訪的14名參與者中,大部分不良事件都是輕度或中度,未出現(xiàn)嚴(yán)重不良反應(yīng)。[3]
最常見的不良事件包括腹瀉、頭痛、惡心、口腔潰瘍、中性粒細(xì)胞減少以及皮疹。研究團(tuán)隊(duì)評估認(rèn)為,這些不良反應(yīng)普遍較輕,通常在干細(xì)胞輸注后約6天內(nèi)出現(xiàn),并在30天內(nèi)自行緩解。(見下圖)
未來展望:臨床落地時(shí)間表預(yù)測
基于當(dāng)前進(jìn)展,干細(xì)胞治療1型糖尿病的時(shí)間表已經(jīng)初步清晰。2025年福泰制藥的全球首款針對1型糖尿病的干細(xì)胞療法3期臨床即將完成,預(yù)計(jì)明年申報(bào)上市。如果獲批,該藥物將有望使歐美等地區(qū)因現(xiàn)有治療手段受限而反復(fù)出現(xiàn)嚴(yán)重低血糖事件的患者受益
未來1-2年內(nèi),我們可能會看到有條件批準(zhǔn)的干細(xì)胞產(chǎn)品上市,適用于最需要的患者群體。
3-5年內(nèi),隨著技術(shù)優(yōu)化和免疫方案改進(jìn),適應(yīng)癥可能會擴(kuò)大,更多患者能夠從中受益。
5-10年后,基因編輯技術(shù)可能推動“通用型”干細(xì)胞產(chǎn)品的出現(xiàn),進(jìn)一步降低免疫排斥風(fēng)險(xiǎn)和治療成本。
意義:患者角度的風(fēng)險(xiǎn)-收益評估
從患者視角看,干細(xì)胞治療帶來了前所未有的希望,但也需理性看待。
治療效益:重塑糖尿病管理的未來
對于1型糖尿病(T1D)患者而言,干細(xì)胞治療如同一束曙光,有望徹底改變疾病管理模式。其核心優(yōu)勢在于功能性治愈的可能性:
- 胰島素獨(dú)立:通過干細(xì)胞分化為功能性β細(xì)胞,患者可能擺脫每日胰島素注射的繁瑣,實(shí)現(xiàn)自主調(diào)節(jié)血糖的能力。
- 血糖穩(wěn)定控制:干細(xì)胞療法可模擬生理性的胰島素分泌模式,顯著降低血糖波動,減少夜間低血糖事件的發(fā)生率。
- 并發(fā)癥預(yù)防:長期穩(wěn)定的血糖控制能延緩或逆轉(zhuǎn)糖尿病相關(guān)并發(fā)癥(如視網(wǎng)膜病變、腎病),提升患者生存質(zhì)量。
- 免疫耐受重建:部分療法通過調(diào)節(jié)自身免疫系統(tǒng),可能減少對胰島β細(xì)胞的持續(xù)攻擊,為長期療效提供保障。
風(fēng)險(xiǎn)與挑戰(zhàn):理性看待科學(xué)邊界
盡管前景廣闊,但患者仍需清醒認(rèn)識當(dāng)前的技術(shù)局限性:
- 個體差異顯著:療效可能因患者年齡、病程、免疫狀態(tài)等因素而異,無法保證“普適性”。
- 免疫排斥風(fēng)險(xiǎn):異體干細(xì)胞移植需依賴免疫抑制劑,可能增加感染或腫瘤風(fēng)險(xiǎn);自體干細(xì)胞療法成本高昂且技術(shù)復(fù)雜。
- 經(jīng)濟(jì)負(fù)擔(dān)沉重:目前單次治療費(fèi)用可達(dá)數(shù)萬元,遠(yuǎn)超普通家庭承受范圍,及需醫(yī)保或政策支持。
患者行動建議:把握機(jī)遇,規(guī)避風(fēng)險(xiǎn)
參與臨床試驗(yàn):優(yōu)先選擇經(jīng)正規(guī)審批的臨床試驗(yàn),在專業(yè)團(tuán)隊(duì)指導(dǎo)下體驗(yàn)前沿療法。
關(guān)注監(jiān)管動態(tài):密切跟蹤FDA或NMPA的審批進(jìn)展,等待成熟療法上市后再評估可行性。
權(quán)衡風(fēng)險(xiǎn)-收益:與醫(yī)生充分溝通,結(jié)合自身病情(如嚴(yán)重低血糖史、并發(fā)癥程度)制定個性化干細(xì)胞決策。
警惕非正規(guī)宣傳:拒絕“包治百病”的干細(xì)胞噱頭,謹(jǐn)防非法機(jī)構(gòu)以“祖細(xì)胞療法”為名行詐騙之實(shí)。
結(jié)語:希望與挑戰(zhàn)并存的 “黎明前”
干細(xì)胞治療1型糖尿病已經(jīng)取得了從“0到1”的革命性突破,首次在臨床上實(shí)現(xiàn)了讓1型糖尿病患者“脫離胰島素”的夢想。當(dāng)前的研究正從“證明概念”轉(zhuǎn)向“優(yōu)化方案”,聚焦于提升安全性、耐久性和可及性。
雖然前路仍有挑戰(zhàn),但毋庸置疑,干細(xì)胞技術(shù)正引領(lǐng)我們走向一個徹底改寫糖尿病治療史的新時(shí)代,為數(shù)百萬患者點(diǎn)燃了治愈的曙光。
相關(guān)閱讀:
全球首例:自體干細(xì)胞移植實(shí)現(xiàn)1型糖尿病患者持久胰島素獨(dú)立
新研究有望終結(jié)胰島素注射!《糖尿病雜志》:干細(xì)胞治療1型糖尿病迎來轉(zhuǎn)機(jī)
參考資料:
[1]Wu, J., Li, T., Guo, M.?et al.?Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue.?Cell Discov?10, 45 (2024). https://doi.org/10.1038/s41421-024-00662-3
[2]https://www.thepaper.cn/newsDetail_forward_30703516
[3]https://www.nejm.org/doi/full/10.1056/NEJMoa2506549
[4]https://www.nikkei.com/article/DGXZQOUF142ZG0U5A410C2000000/
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時(shí)聯(lián)系我。




 掃碼添加官方微信
掃碼添加官方微信