簡介:目前,原位肝移植被認為是治療慢性肝硬化終末期最有效的方法。由于原位肝移植的局限性,干細胞是一種有吸引力的治療選擇。間充質干細胞 (MSC) 在動物模型和臨床試驗中尤其顯示出作為肝硬化替代療法的希望。然而,移植的MSCs歸巢到肝臟的數量有限。因此,我們回顧了增強間充質干細胞歸巢的策略,主要是通過傳遞途徑、優化細胞培養條件、刺激靶位點和基因修飾。

間充質干細胞:治療肝硬化的潛在應用
背景
肝硬化是由于各種原因引起的進行性纖維化的終末期,對藥物保守治療反應不佳。肝臟的慢性損傷導致肝細胞中細胞外基質 (ECM) 的廣泛積累。流行病學數據表明,全世界每年有103萬肝硬化患者死于嚴重的相關并發癥。
目前,肝移植是晚期肝病最有效的治療方法。在有幸接受肝移植的患者中,3、12和36個月的生存率分別為94%、88%和79%。但要考慮供體器官缺乏、費用高、移植后需要長期使用免疫抑制劑等問題。因此,迫切需要尋找替代治療策略。近期研究表明,肝硬化肝細胞仍有再生潛力,但再生與壞死之間存在不平衡。一個潛在的假設表明,可以通過注入的細胞增殖來重塑受損的肝臟,從而形成一個功能齊全的肝臟部分。僅增加肝細胞數量是否對患者有效是值得懷疑的。
基于概念驗證,移植肝細胞以治療肝臟相關疾病。由于肝細胞數量有限,且缺乏體外增殖和穩定性,移植肝細胞的療效逐漸下降。因此,找到另一個容易獲得的細胞來源至關重要。
本綜述旨在強調目前所有關于使用干細胞治療肝硬化的可用證據,并確定其潛力是否有任何事實依據。
再生醫學中的干細胞
干細胞,稱為克隆形成未分化細胞,不能無限期地自我更新,而是可以分化成多種細胞譜系,包括多能胚胎干細胞 (ESC)、誘導多能干細胞 (iPSC)、造血干細胞 (HSC)、肝細胞干細胞、間充質干細胞 (MSC) 等(圖 1)。
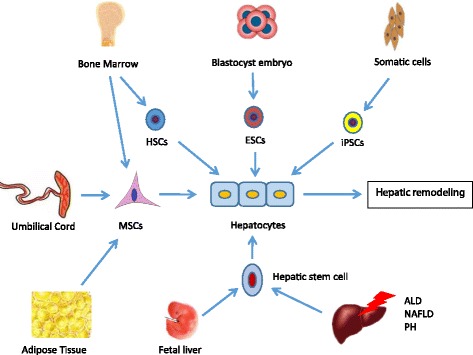
ALD酒精性肝病、ESCs胚胎干細胞、HSCs造血干細胞、iPSCs誘導多能干細胞、MSCs間充質干細胞、NAFLD非酒精性脂肪性肝病、PH肝部分切除術
目前應用治療肝硬化的干細胞主要是間充質干細胞
有證據表明,間充質細胞通過間充質-上皮或上皮-間質轉化 (MET/EMT) 過程可能有助于慢性肝損傷期間的成人肝再生。肝臟中的間充質細胞可能不僅來自其自身的祖細胞,還可能通過遷移至受損肝臟而來自骨髓 (BM) ,盡管這種說法存在爭議。這表明不僅 HPC,而且間充質細胞同時促進肝病的發生和發展,盡管其機制仍不清楚。這表明 HPC 和間充質細胞之間的相互作用對于損傷肝臟的重塑很重要。越來越多的證據表明,HPC 可能是治療肝損傷的最佳替代療法;然而,HPC可能會導致癌變和纖維化,正如體外研究顯示的那樣。在全面了解其治療潛力之前,有必要更好地了解決定HPC分化及其可能惡性轉化的因素。
MSCs的治療潛力以及它們的分化、免疫調節特性和營養因子的分泌已得到廣泛研究。與ESC、iPSC和HPC 相比,MSC不存在任何倫理問題,已成為理想的替代品。
在過去的幾年中,MSCs主要是從骨髓 (BM-MSCs) 中分離出來的。已經提出了MSC的替代來源,例如脂肪組織 (AD-MSC)、臍帶血 (CB-MSC)、臍帶 (UC-MSC) 和羊水。
間充質干細胞治療肝硬化的應用
BM-MSCs 能夠分化為肝細胞并恢復肝功能,表現為肝星狀細胞凋亡、轉化生長因子 (TGF)-β1 和α-平滑肌肌動蛋白 (α-SMA) 基因表達降低。AD-MSCs比BM-MSCs具有更高的免疫相容性和更容易分離,對肝纖維化具有保護作用。與BM-MSC相比,UC-MSC顯示出更有益的免疫原性特征和更強的整體免疫抑制潛力。
盡管已經在體內證實了MSC向肝細胞的分化,但有證據表明,各種營養和免疫調節因子在肝纖維化的治療中起著關鍵的治療作用。MSCs分泌的營養因子在抗凋亡因子(肝細胞生長因子(HGF)和胰島素樣生長因子(IGF-1))、血管生成因子(血管內皮生長因子(VEGF))的幫助下阻止肝細胞凋亡)、有絲分裂因子(表皮生長因子 (EGF)、HGF和神經生長因子 (NGF))和TGF-α。由于較小且不太復雜的免疫原性效力,無 MSC 療法可能構成更好的替代療法。
進一步的臨床試驗評估了移植的MSCs治療肝纖維化患者的效率。已經設計了多項臨床試驗來評估它們在肝硬化治療中的治療潛力(表格1)。

研究結果似乎很有希望,終末期肝病 (MELD) 評分和代謝參數模型有所改善,但組織學改善的數據薄弱。UC-MSC治療后的長期結果更適合肝硬化患者,盡管輸注BM-MSC的短期療效良好。應該注意的是,每個患者的輸注細胞數量、遞送途徑和注射頻率在研究中有所不同。不同來源的MSCs和不同的患者群體可能對任何治療效果更有說服力。
Gholamrezanezhad等人表明,在1個月的隨訪期后,肝功能沒有顯著改善,因為BM-MSC進入肝臟的歸巢能力僅發生在有限數量的輸注細胞中。彭等還提到,MSCs的歸巢能力是自體MSCs移植未能對患者預后取得可接受的長期效果的主要原因。基于細胞的療法的揮之不去的問題是遞送的細胞是否在受傷部位內歸巢以及如何提高它們的歸巢能力。
增強間充質干細胞歸巢的策略
受損組織內的遷移或歸巢受多種因素影響,包括遞送途徑、注入細胞的數量、培養條件等。我們回顧了與 MSC遷移相關的各種因素。
MSCs的給藥途徑
MSC的遞送途徑似乎對治療效率至關重要。MSCs的傳統給藥主要通過肝內注射、脾內注射和靜脈輸注。細胞的全身輸送可能會導致毛細血管內細胞的大量快速丟失,尤其是在肺部,這會縮短剩余MSC的壽命。此外,用肝素輸注細胞會顯著減少肺內截留的AD-MSC數量,并增加肝臟中積累的細胞數量。血管通暢可能是MSC流入目標組織的重要因素。肝內注射似乎是施用干細胞的理想方式,循環中的細胞滯留較少,并且更多的MSC分化為肝細胞。此外,通過門靜脈或肝動脈給予MSCs的歸巢效率分別低于5%和20-30%。因此,肝動脈似乎是最好的輸送途徑,并顯示出更好的歸巢效果;但輸液前應檢查血管通暢情況。
優化栽培條件
在擴張過程中,新分離的MSC會失去響應遷移信號的配體或受體。遷移是一個依賴通道的過程;傳代次數越多,歸巢的效率就會降低。此外,由于金屬蛋白酶組織抑制劑 (TIMP)-3的上調,高培養匯合度會損害 MSC的遷移。此外,缺氧會誘導瘦素的表達,瘦素與STAT3/缺氧誘導因子-1α (HIF-1α)/VEGF 和基質細胞衍生因子 (SDF)-1/CXCR4信號通路的激活有關。建議缺氧預處理增加 MSCs 的募集。
刺激目標位點募集MSC動員
在損傷的急性期,受損組織釋放的炎性細胞因子募集單核細胞進行組織修復。與未受照射的小鼠相比,接受全身照射的小鼠體內有更多的MSCs,這表明注入的 MSCs 首先被移動到受傷部位。然而,在疾病處于亞慢性或慢性期的患者中,一些不可或缺的歸巢趨化因子可能很少或不存在;因此,外部刺激可能為歸巢提供一種簡單且可用的新方法。
轉基因MSC
由于配體和受體之間存在特異性整合,一種假設是改變 MSC 上受體/配體的水平可能會提高目標組織內的歸巢效率。
在損傷的急性期,受損組織釋放大量基質細胞衍生因子 (SDF-1α),但它們的受體 (CXCR4) 在培養的 MSCs 上處于低水平。具有過表達CXCR4的MSC具有更好的向SDF-1α遷移的潛力,并分泌更多的營養因子,包括刺激肝細胞再生的HGF和VEGF。Ryu 等人進一步解釋了Akt、ERK和p38信號通路也與SDF-1/CXCR4軸有關。
HGF是肝細胞再生中最有效的有絲分裂原,在組織損傷期間,其生物學效應依賴于酪氨酸激酶受體和細胞間充質上皮轉化因子 (c-met) 。c-met 的遺傳缺失會損害肝卵圓細胞的潛能,包括它們的增殖、遷移和分化。劉等人證明HGF/c-met 信號通路對于MSC在受損肝臟內歸巢至關重要,并且它促進肝臟修復。MSCs 上過表達的受體或配體對應于從受傷器官釋放的特定細胞因子,可以直接在目標組織內誘導歸巢。
結論
本綜述表明干細胞療法具有良好的治療效果。目前,決定間充質干細胞益處的關鍵因素是歸巢功效。間充質干細胞治療在臨床試驗中的缺點包括醫源性腫瘤發生、細胞栓塞和細胞輸注的最佳時間的風險。此外,其在臨床試驗中的安全性應得到機構倫理委員會的批準。總之,干細胞治療肝硬化的結果是有希望的。
參考資料:Zhang Y, Li Y, Zhang L, Li J, Zhu C. Mesenchymal stem cells: potential application for the treatment of hepatic cirrhosis. Stem Cell Res Ther. 2018 Mar 9;9(1):59. doi: 10.1186/s13287-018-0814-4. PMID: 29523186; PMCID: PMC5845383.
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。
版權說明:本文來自杭吉干細胞科技內容團隊,歡迎個人轉發至朋友圈,謝絕媒體或機構未經授權以任何形式轉載至其他平臺,轉載授權請在網站后臺下方留言獲取。




 掃碼添加官方微信
掃碼添加官方微信