類風濕關節炎(Rheumatoid Arthritis, RA)是一種以慢性炎癥性滑膜炎為特征的自身免疫性疾病,常導致關節破壞和功能障礙。盡管傳統治療(如DMARDs、生物制劑)在緩解癥狀方面取得一定成效,但部分患者仍面臨耐藥性、副作用及疾病進展等問題。
近年來,干細胞技術因其免疫調節、抗炎及組織修復能力,成為RA治療的新方向。2025年1月至12月,干細胞治療RA領域取得多項突破性進展,本文將梳理這一時間段干細胞治療類風濕關節炎的關鍵研究與臨床實踐,為醫學界和類風濕關節炎患者提供最新的新聞資訊。

2025年1-12月干細胞治療類風濕關節炎臨床進展匯總
2025年1月干細胞治療類風濕關節炎最新臨床進展
1月7日,國際知名期刊《International Immunopharmacology》上發表了一篇關于《細胞治療在類風濕關節炎中的應用:聚焦間充質干細胞的免疫調節策略》的研究成果。[1]
該研究系統評估了間充質干細胞(MSCs)在類風濕性關節炎(RA)治療中的免疫調節作用及臨床療效。

研究顯示:
同種異體MSCs:顯著提升患者血清中抗炎因子IFN-γ和IL-10水平,同時調節Treg/Th17細胞比例,改善免疫失衡。
自體骨髓MSCs(BM-MSCs):在難治性RA患者中,移植后Th17細胞數量、疾病活動評分(DAS28-ESR)及疼痛評分(VAS)均顯著下降,且IL-10和TGF-β水平升高,提示免疫調節效應。
臍帶MSCs(UC-MSCs):靜脈輸注后,患者紅細胞沉降率(ESR)和DAS28評分顯著改善,促炎因子(IL-1β、IL-6、TNF-α)水平降低,炎癥反應得到有效控制。
脂肪來源MSCs(AD-MSCs):單次輸注后52周隨訪未報告嚴重不良事件,驗證其長期安全性。
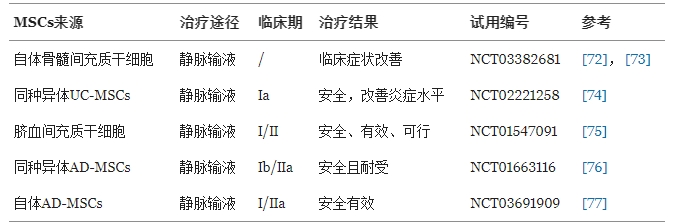
總體來看,MSCs通過多靶點免疫調節機制(如抑制Th17、促進Treg分化、降低促炎因子)緩解RA癥狀,且在多種來源(骨髓、臍帶、脂肪)中均表現出良好療效與安全性。
1月15日,意大利科研人員在《Heliyon》上發表了一篇關于《探索圍產期間充質基質細胞作為類風濕性關節炎的潛在治療策略》的研究成果。[2]

多項體外實驗表明,圍產期MSC可調控先天性和適應性免疫細胞的增殖、分化及細胞因子分泌,有效抑制炎癥反應。動物模型進一步驗證,MSC治療顯著改善RA相關關節炎癥和軟骨損傷,提示其通過免疫調節和抗炎作用緩解疾病進展。
2025年2月干細胞治療類風濕關節炎最新臨床進展
2月13日,伊朗德黑蘭醫科大學在國際期刊《Molecular Biology Reports》上發表了一篇關于《間充質干細胞來源的外泌體及其在治療類風濕性關節炎中的潛在治療作用的綜述》的研究成果。[3]

近年來,干細胞衍生外泌體(MSC-EVs)因其獨特的藥物遞送能力、免疫調節功能及安全性,成為RA治療研究的熱點。
研究表明,MSC-EVs可靶向遞送抗炎藥物(如抗TNF-α)、miRNA(如miR-320a、miR-150-5p)及代謝調控因子,通過抑制Th17細胞分化、促進Treg細胞增殖、阻斷NF-κB信號通路等機制,顯著減輕滑膜炎癥、抑制軟骨破壞,并延緩疾病進展。
相比直接注射MSC細胞,外泌體避免了腫瘤形成、免疫排斥等風險,且可通過工程化改造(如負載特定miRNA)增強治療精準性。多項臨床試驗(如關節內注射)證實其有效性,為RA提供了低風險、高效率的新型治療策略,未來有望成為替代傳統療法的重要選擇。
2025年3月干細胞治療類風濕關節炎最新臨床進展
3月5日,行業期刊《干細胞研究與治療》上發表了一篇關于《脂肪干細胞通過恢復 CX3CR1+滑膜內層巨噬細胞屏障減輕類風濕性關節炎》的研究成果。[4]

究發現,RA進展過程中存在氧化磷酸化功能受損的Atf3?Ccl3?CX?CR??巨噬細胞亞群,其數量增加與疾病惡化相關。通過血清轉移性關節炎小鼠模型結合單細胞/批量RNA測序分析,團隊證實ADSC可通過以下機制發揮治療作用:
線粒體轉移:ADSC向巨噬細胞轉移線粒體,修復其能量代謝障礙,分離的ADSC線粒體單獨移植即可顯著改善RA癥狀。
屏障修復:ADSC粘附并激活CX?CR??巨噬細胞,通過Cd74/Mif軸和GAS6/MERTK軸促進屏障重建,缺失該屏障則顯著削弱治療效果。
多靶點調控:ADSC同時激活組織修復通路并抑制炎癥反應,批量RNA-seq顯示其增強免疫調節能力。
該成果首次闡明ADSC通過靶向巨噬細胞代謝異常及屏障修復機制緩解RA,為開發基于線粒體轉移或靶向CX?CR??巨噬細胞的精準療法提供了理論依據,有望突破傳統RA治療的局限性。
2025年4月干細胞治療類風濕關節炎最新臨床進展
4月28日,我國臺灣科研人員在期刊《分子生物學報告》上發表了一篇關于《反式茴香腦增強間充質干細胞來源的外泌體功能,抑制H2O2誘導的HIG?-82滑膜細胞類風濕性關節炎樣炎癥》的研究成果。[5]
本研究探討了反式茴香腦(源自茴香)預處理的人類沃頓膠間充質干細胞(hWJMSCs)外泌體對類風濕性關節炎(RA)樣炎癥的治療作用。

結果顯示:
細胞功能增強:茴香腦處理顯著提升hWJMSCs的細胞活力及干性標志物(如CD90)表達,并促進增殖相關蛋白(細胞周期蛋白D、PCNA、MCM2)表達,同時抑制p53/p21凋亡通路。
抗炎與抗凋亡效應:經茴香腦預處理的外泌體在H?O?誘導的滑膜細胞模型(HIG-82)中,顯著降低ECM降解酶(MMP-13、ADAMTS系列)和AQP-3的表達,且比未處理外泌體更有效減少凋亡標志物(Bax、Cyto c、c-caspase 3),同時上調抗凋亡蛋白Bcl-2。
總之,研究表明,來自茴香腦預處理的hWJMSC的外泌體具有更大的潛力來抑制H?O?處理的HIG-82細胞中的RA樣炎癥和細胞凋亡。
2025年5月干細胞治療類風濕關節炎最新臨床進展
5月初,沙特阿拉伯塔布克大學牽頭在國際期刊《Immun Inflamm Dis》上發表了一篇關于《間充質干細胞治療的臨床進展:以風濕病為重點》的研究成果。[6]

本研究全面回顧了間充質干細胞(MSC)治療風濕性疾病(包括系統性紅斑狼瘡、類風濕性關節炎、強直性脊柱炎、骨關節炎、骨質疏松癥、干燥綜合征、克羅恩病、纖維肌痛、系統性硬化癥、皮肌炎和多發性肌炎)的臨床前及臨床研究。
其中關于間充質干細胞治療類風濕關節炎, 臨床前和臨床研究表明,MSC療法可以減輕炎癥、調節免疫反應并促進類風濕關節炎的組織修復,并延緩關節畸形進展,長期安全性良好(大規模研究未見嚴重不良事件)。
研究同時指出,MSC標準化制備、長期安全性驗證及聯合療法開發是未來突破方向,預示其有望成為風濕病治療的重要創新手段。
2025年6月干細胞治療類風濕關節炎最新臨床進展
6月16日,莫斯科謝切諾夫第一國立醫科大學再生醫學研究所牽頭在《國際分子科學雜志》上發表了一篇名為《炎癥性關節炎再生療法的進展:探索間充質干細胞和細胞外囊泡的潛力》的研究文章。[7]

炎性關節炎,包括類風濕性關節炎 (RA) 和骨關節炎 (OA),是一組退行性關節疾病,會導致活動受限,并成為致殘的常見原因。
研究結果表示,干細胞及其分泌的外泌體在類風濕關節炎治療中展現出很大潛力。現有臨床試驗顯示,關節內或靜脈注射MSC能減輕炎癥、緩解疼痛、改善關節功能,甚至在部分患者中促進軟骨修復。整體安全性較好,常見副作用多為輕中度,并可自行緩解。
不過,療效因人而異,受到MSC來源、供體年齡和培養方法等因素影響。現階段試驗規模還不大,也缺乏統一的標準化方案。未來,如果結合基因工程、生物材料或iPSC衍生的MSC,提升療效和生產可控性,MSC和EV療法有望在RA治療中發揮更大作用。
2025年7月干細胞治療類風濕關節炎最新臨床進展
7月9日,行業期刊《Stem Cell Research & Therapy》上發表了一篇名為《綜述:多種來源的間充質基質細胞治療類風濕關節炎的進展和異質性》的研究成果。[8]

研究表明,間充質干細胞(MSC)有望成為有效治療類風濕性關節炎(RA)的良藥。就長期療效而言,一些細胞療法已顯示出實現持久疾病緩解的潛力,甚至可能減少患者對傳統藥物的依賴。
MSC可通過分泌抗炎因子抑制炎癥反應,并促進Treg細胞恢復免疫平衡,從而減少關節損傷。相比傳統的DMARD或JAK抑制劑,MSC更傾向于局部調控,感染風險更低。同時,MSC分泌的細胞外囊泡(EVs)也能在炎癥環境中發揮免疫調節作用。
此外研究人員在技術層面進行了優化,從基因編輯到廣泛應用的靶向納米技術來解決MSC的歸巢效應,以及隨后出現的3D打印技術,進一步促進了軟骨組織的再生和修復。
但是,MSC異質性的挑戰需要更多的臨床應用研究,因為不同來源、培養條件和功能亞群的MSC在治療中表現出顯著差異,導致療效波動,通常會在三個月后會觀察到療效降低。
總體來看,MSC療法在類風濕性關節炎(RA)治療中展現出巨大的潛力,但其臨床轉化仍面臨諸多挑戰。現有研究雖然證實了MSC的免疫調節和組織修復能力,但其療效和長期安全性的異質性仍需通過更嚴格的臨床試驗予以解決,并需制定標準化的治療方案。
2025年8月干細胞治療類風濕關節炎最新臨床進展
8月1日,我國科研人員在《Medicine》期刊雜志上發表了一篇名為《細胞外囊泡在類風濕關節炎中的作用:文獻計量分析》的研究文章。[9]

本次研究從Web of Science核心合集數據庫中檢索近20年來的相關文獻,共分析了來自59個國家/地區922家機構的512篇出版物(311篇文章和201篇綜述)。
近十年來,在類風濕性關節炎(RA)和胞外囊泡(EVs)的研究中,EVs已被證實在調節炎癥、破壞免疫平衡和驅動RA關節破壞方面發揮著重要作用。
另一方面,來源于間充質干細胞(MSC)的EVs(MSC-EVs)在RA治療中也展現出很大潛力。它們能調控T細胞、巨噬細胞和滑膜成纖維細胞的活性,減輕炎癥、緩解滑膜增生、促進軟骨修復,還能改善骨代謝。
相比直接用干細胞,MSC-EVs更安全、免疫反應低,而且可以靶向炎癥部位發揮作用,正成為一種比較有前景治療方案。
2025年9月干細胞治療類風濕關節炎最新臨床進展
9月28日,國家藥監局的一則公示,為類風濕關節炎的細胞治療賽道再添一把火。新藥品CXSL2500562臍帶間充質干細胞注射液正式獲準進入臨床,劍指RA。[10]
值得注意的是,這已是國內第二款獲批臨床的同類療法,預示著這一創新賽道正迅速升溫,競爭格局悄然成形。
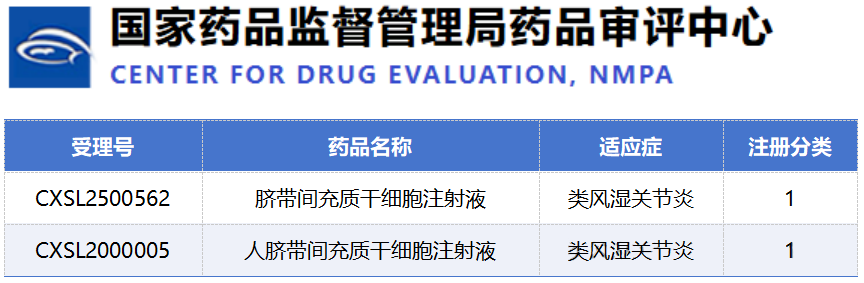
隨著 CXSL2500562 以及其他干細胞類藥物項目進入臨床或推進至關鍵節點,未來將有更多高質量試驗數據陸續披露。這些數據將為RA患者提供潛在的新型治療選擇,也將推動行業在以下幾個重點方向上加速突破:
- 細胞來源與制劑工藝的優選:如何提升治療一致性與可控性;
- 給藥方式與劑量優化:探索靜脈注射、關節腔注射等不同路徑的差異化療效;
- 長期安全性與成本效益評估:為臨床應用與支付機制打下基礎;
- 臨床分型精準治療:基于患者分型/反應特點開發靶向性干細胞治療策略。
可以預見,隨著這些前沿項目在臨床試驗中逐步釋放數據,干細胞療法在類風濕關節炎領域的科學證據和應用潛力將持續擴展,或為這一頑固性慢性炎癥性疾病帶來全新的治療路徑。
2025年10月干細胞治療類風濕關節炎最新臨床進展
10月,浙江大學國家重點實驗室牽頭在《ACS應用材料與界面》上發表了一篇名為《用于局部治療類風濕性關節炎的可注射溫敏水凝膠包裹間充質干細胞膜仿生脂質體》的研究成果。[11]

本研究將間充質干細胞膜仿生脂質體(MSCsome)負載到用于RA治療的可注射溫敏水凝膠中。
具體而言,注射到關節腔內的溫敏水凝膠由于其緩慢的降解速率,能夠實現地塞米松(Dex)包裹的MSCsome的持續局部釋放,隨后,由于其固有的靶向能力,Dex-MSCsome可被活化的巨噬細胞內吞。
實驗結果顯示,這種“水凝膠+MSC膜仿生脂質體”的復合治療策略,不僅顯著降低關節炎癥和疼痛,還有效促進受損軟骨的修復,為類風濕性關節炎的局部精準治療提供了全新的思路。
綜上,該研究展示了一種基于干細胞膜仿生載體與溫敏水凝膠結合的靶向遞藥平臺,在未來有望進一步拓展至其他慢性炎癥性疾病或再生醫學領域。
2025年11月干細胞治療類風濕關節炎最新臨床進展
11月17日,重慶醫科大學附屬第一醫院牽頭在《干細胞研究與治療》上發表了一篇名為《間充質干細胞聯合IFN-γ治療與間充質干細胞單藥治療:五年延長隨訪期間的安全性和有效性》的臨床成果。[12]
結果顯示,對于傳統治療效果不佳的患者,間充質干細胞聯合干擾素-γ(IFN-γ)療法不僅安全性良好,而且療效顯著優于單藥治療。
療效表現:
- 病情改善顯著:ACR20顯著改善率在治療1年時達100%,五年后仍保持在89.3%,明顯高于單藥組。
- 疾病活動度降低:低疾病活動度患者占42.9%,臨床緩解患者占25%,均高于單藥組。
- 生活質量提升:DAS28和HAQ-DI評分顯示關節癥狀及身體功能長期改善,患者生活質量穩定提高。
- 藥物減負:多數患者減少甚至停用激素和生物制劑,降低長期用藥風險。
安全性:五年隨訪期間嚴重不良事件極少,最常見輕微反應為短期淋巴細胞下降,可自行恢復,無惡性腫瘤或死亡病例。
總體來看,該聯合療法起效快速、療效穩固,為難治性RA患者提供了長期、高質量的生活改善新方案。
2025年12月干細胞治療類風濕關節炎最新臨床進展
12月23日,伊朗大不里士醫科大學神經科學研究中心牽頭在《Biologics: Targets and Therapy》上發表了一篇名為《間充質干細胞療法在骨關節炎和類風濕性關節炎中的應用:外泌體微RNA的系統評價》的研究成果。[13]

其中關于干細胞治療類風濕關節炎的研究顯示,間充質干細胞(MSC)及其來源的外泌體(MSC-EVs)在類風濕性關節炎(RA)中具有顯著的抗炎和免疫調節作用。MSC-EVs攜帶特定的miRNA(如miR-146a、miR-150-5p、miR-223、miR-34、miR-320),可被RA滑膜成纖維細胞(RA-FLS)吸收,從而抑制滑膜細胞的增殖、遷移和炎癥反應,降低促炎因子生成,并調控關鍵免疫信號通路(如NF-κB、ATM/p53及NLRP3炎癥小體)。
不同來源的MSC,包括骨髓(BM-MSC)、臍帶(UC-MSC)、脂肪(AD-MSC)及滑膜(S-MSC),在實驗中均顯示出類似療效。此外,經特定miRNA修飾或預處理的MSC外泌體可進一步增強治療效果。
總體而言,MSC及其衍生外泌體miRNA在減輕關節炎癥、保護軟骨及調節免疫反應方面展現出良好潛力,為RA提供了一種新型治療策略,但仍需更多臨床研究以驗證其安全性和長期療效。
2025年干細胞治療類風濕關節炎最新臨床進展總結
2025年,干細胞治療類風濕關節炎(RA)取得了顯著進展。研究顯示,干細胞具有免疫調節、抗炎和組織修復能力,可減輕關節炎癥、抑制軟骨破壞,并改善關節功能和患者生活質量。臨床和實驗結果均表明,干細胞治療安全性良好,療效穩定,對難治性患者尤其具有潛力。
同時,多項新策略不斷推動干細胞療法升級,如聯合藥物治療、工程化改造及靶向遞藥系統,這些方法有助于提高治療精準性和持久性。總體來看,干細胞為RA提供了低風險、高潛力的新型治療方案,但仍需更多大規模、長期臨床試驗驗證其安全性與長期療效。
未來展望
干細胞療法的突破性進展為RA治療提供了創新路徑,其多維度作用機制(如免疫調節、代謝修復、抗炎)突破了傳統藥物單一靶點的局限性,有望解決RA患者長期面臨的疾病緩解率低、副作用大等問題。
未來需聚焦標準化制備工藝、長期療效驗證及個體化治療策略的優化,推動干細胞療法從實驗室研究向臨床廣泛應用轉化,最終惠及全球數百萬RA患者,重塑風濕病治療格局。
結語
2025年,干細胞治療類風濕關節炎領域迎來多項突破:間充質干細胞通過多靶點免疫調節顯著緩解炎癥與疼痛,外泌體等新型載體技術提升治療精準性,脂肪干細胞修復滑膜屏障機制開辟新方向。研究不僅驗證了干細胞在安全性、長期療效上的潛力,更推動RA治療從“癥狀控制”向“免疫重塑與組織修復”轉型。
未來,隨著標準化制備工藝的完善和聯合療法的探索,干細胞有望成為顛覆傳統治療范式的核心力量,為全球RA患者帶來更高效、低風險的解決方案。
參考資料:
[1]Zhi Feng, Ying Yang, Xiang-zhuo Liu, Hui-jiao Sun, Bo-ya Wen, Zhi Chen, Bo Wei,Application of cell therapy in rheumatoid Arthritis: Focusing on the immunomodulatory strategies of Mesenchymal stem cells,International Immunopharmacology,Volume 147,2025,114017,ISSN 1567-5769,https://doi.org/10.1016/j.intimp.2025.114017.
[2]Exploring perinatal mesenchymal stromal cells as a potential therapeutic strategy for rheumatoid arthritisAlivernini, Stefano et al.Heliyon, Volume 11, Issue 1, e41438
[3]Aghajani, S., Maboudi, S.A., Seyhoun, I. et al. Review of mesenchymal stem cell-derived exosomes and their potential therapeutic roles in treating rheumatoid arthritis. Mol Biol Rep 52, 229 (2025). https://doi.org/10.1007/s11033-025-10290-z
[4]Wang, L., Hao, M., Xu, Y. et al. Adipose-derived stem cells attenuate rheumatoid arthritis by restoring CX3CR1+ synovial lining macrophage barrier. Stem Cell Res Ther 16, 111 (2025). https://doi.org/10.1186/s13287-025-04144-5
[5]Huang, TL., Chang, YC., Kuo, WW. et al. Trans-anethole enhances mesenchymal stem cell derived exosomes function to inhibit H2O2-induced rheumatoid arthritis-like inflammation in HIG-82 synovial cells. Mol Biol Rep 52, 431 (2025). https://doi.org/10.1007/s11033-025-10426-1
[6]Hetta HF, Elsaghir A, Sijercic VC, Ahmed AK, Gad SA, Zeleke MS, Alanazi FE, Ramadan YN. Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. Immun Inflamm Dis. 2025 May;13(5):e70189. doi: 10.1002/iid3.70189. PMID: 40353645; PMCID: PMC12067559.
[7]Klyucherev, T.O.; Peshkova, M.A.; Yurkanova, M.D.; Kosheleva, N.V.; Svistunov, A.A.; Liang, X.-J.; Timashev, P.S. Advances in Regenerative Therapies for Inflammatory Arthritis: Exploring the Potential of Mesenchymal Stem Cells and Extracellular Vesicles. Int. J. Mol. Sci. 2025, 26, 5766. https://doi.org/10.3390/ijms26125766
[8]Wu, S., Ding, S., Wang, Y. et al. Review: progression and heterogeneity of multiple sources of mesenchymal stromal cells for the treatment of rheumatoid arthritis. Stem Cell Res Ther 16, 358 (2025). https://doi.org/10.1186/s13287-025-04515-y
[9]Wang, Tao MDa; Tang, Xiaoxia MDb; Luo, Wen MDa; Chen, Ze Hua MDc; Xia, Yubo MDa; Zhou, Xiaohan MDa; Shu, Yang MDd; Lu, Chen Yin MDe; Su, Wenjie MDe; Chen, Qigang MDf; Shen, Zhen MDf; Zhou, Biao MDg; Luo, Zhiqiang MDf,*. Roles of extracellular vesicles in rheumatoid arthritis: A bibliometric analysis. Medicine 104(31):p e43623, August 01, 2025. | DOI: 10.1097/MD.0000000000043623
[10]cde
[11]https://pubs.acs.org/doi/abs/10.1021/acsami.4c09080?utm_source=chatgpt.com
[12]Yang, Y., He, X., Yao, M.?et al.?Mesenchymal stem cells combined with IFN-γ treatment versus mesenchymal stem cells monotherapy: safety and efficacy over five years extension follow-up.?Stem Cell Res Ther?16, 642 (2025). https://doi.org/10.1186/s13287-025-04772-x
[13]https://www.tandfonline.com/doi/full/10.2147/BTT.S571417?scroll=top&needAccess=true
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信