2024年5月20日,國家藥品監督管理局藥品審評中心(NMPA)官網發布《中國新藥注冊臨床試驗進展年度報告(2023年)》(以下簡稱《報告》)。

《報告》顯示出中國新藥臨床試驗創新與高效并存。從《報告》來看,1類創新藥試驗占新藥臨床試驗登記總量的69.1%。
1類創新藥總體仍處于研發早期階段,但與2022年度相比,Ⅱ、Ⅲ期臨床試驗占比均出現小幅增加。通過《報告》,也能感受到鼓勵研發政策所帶來的積極影響:兒童人群、罕見疾病患者等特定人群用藥的臨床試驗數量呈現顯著增長趨勢,醫學影像學和放射性藥物臨床試驗保持小幅增加。
研發企業在細胞治療、基因治療等新技術領域加強布局,2023年登記細胞和基因治療產品類臨床試驗81項,較2022年增長近1倍。
細胞治療、基因治療等新技術領域引起更多關注。2023年,藥物臨床試驗登記與信息公示平臺登記臨床試驗總量首次突破4000項,達4300項(以CTR計),為歷年登記總量最高,較2022年年度登記總量增長了26.1%,其中新藥臨床試驗(以受理號登記)數量為2323項,與2022年相比,2023年新藥臨床試驗數量增長了14.3%。
其中,2023年共登記81項細胞和基因治療產品類臨床試驗,較2022年增長近1倍。上述81項細胞和基因治療產品類試驗共涉及70個品種(以藥品名稱計),試驗范圍以國內臨床試驗為主(76項,93.8%),適應癥以抗腫瘤藥物為主(42項,51.9%)。從試驗分期分析,以Ⅰ期臨床試驗為主(33項,40.7%),Ⅲ期臨床試驗占比僅為4.9%(4/81)。
CDE發布:2023年細胞治療產品臨床注冊同比增長近1倍,創歷史新高

2023我國干細胞臨床研發進展:近50款新藥獲批!?
干細胞療法是再生醫學的一種形式,是將培養好的干細胞或其衍生物,輸入或植入人體,通過抗炎、調節免疫系統、信號轉導和分化特性等機制,刺激人體自身的愈合過程,并修復體內受損細胞或組織,達到抗衰、治療或預防疾病目的的一種治療方法。
干細胞作為前沿生物技術之一,其創新研究已經成為國家創新的一個重要方向,干細胞被相繼寫入我國《“健康中國2030”規劃綱要》、《“十四五”生物經濟發展規劃》。
我國干細胞基礎研究不斷取得突破,獲批臨床試驗的研究數目不斷增多據統計,截止到2023年12月,全球已注冊登記的干細胞相關臨床項目多達4000余項,其中包含3101項已完成的項目,主要涉及自身免疫性疾病(如系統性紅斑狼瘡)、代謝性疾病(如糖尿病)、呼吸系統疾病(如慢阻肺)、骨關節病(如骨關節炎、類風濕關節炎)、生殖系統疾病(如男性勃起功能障礙)、肝臟疾病、眼科疾病等多個領域。
這其中,我國已有50余項間充質干細胞藥物臨床試驗,包括糖尿病足潰瘍、骨關節炎、類風濕關節炎、肺纖維化、卒中、銀屑病、急性呼吸窘迫綜合征、肝衰竭、克羅恩病、移植物抗宿主病等病種。隨著更多臨床試驗數量增加,預計到2028年,中國干細胞市場經濟的復合年均增長率將達到16.5%。
2023年IND受理的干細胞新藥
2023年取得IND受理的干細胞新藥有42個,均為治療用生物制品1類新藥,未有納入特殊審批/重大專項/優先審評/突破性治療品種/附條件批準上市等的新藥。
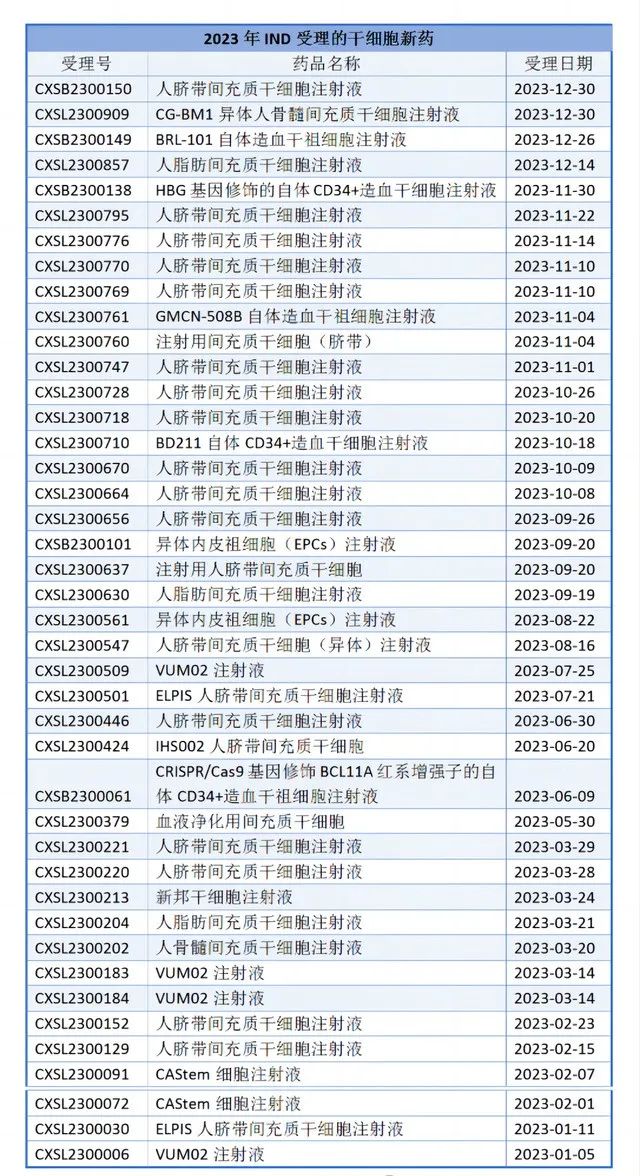
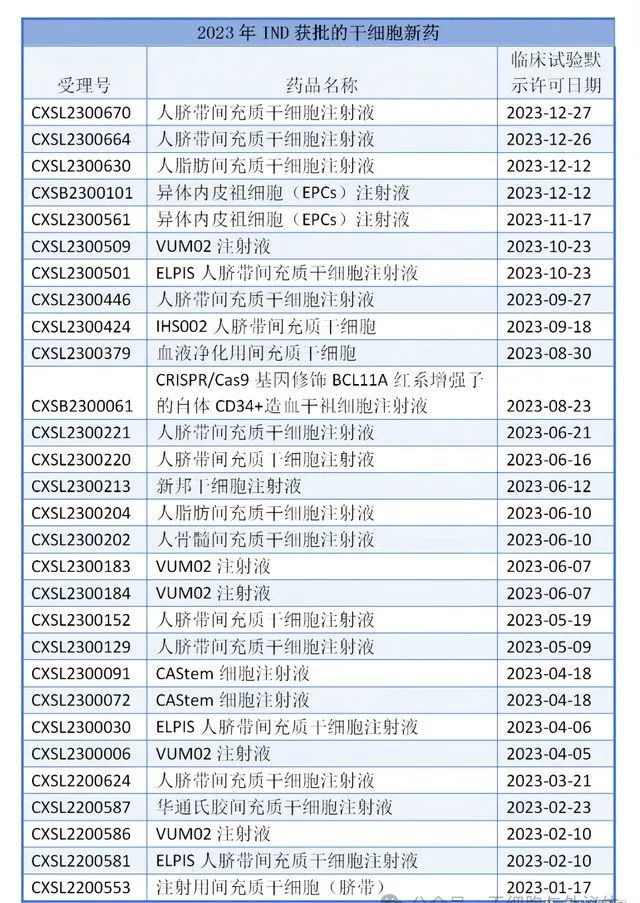
42個IND受理的干細胞新藥62%為臍帶來源干細胞,相比于骨髓間充質干細胞和脂肪間充質干細胞,臍帶間充質干細胞具有更高增殖率、多能性、低免疫原性以及對供體無風險等優點。近年來,基于臍帶間充質干細胞的藥物開發和臨床試驗逐漸增多,治療領域也隨之不斷拓展。
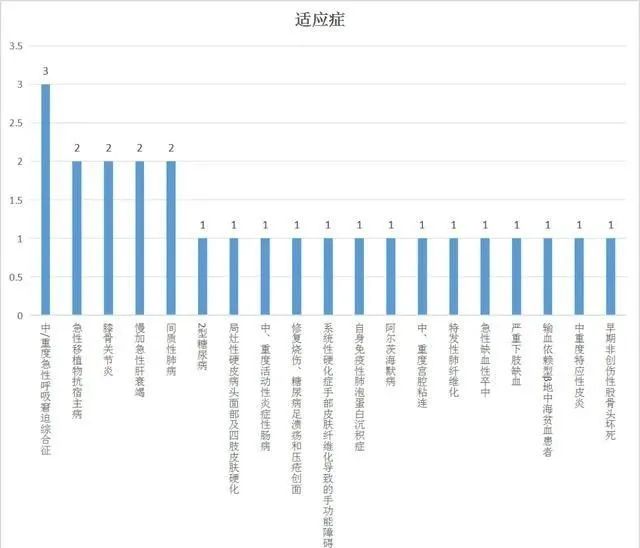
42個IND受理的干細胞新藥適應癥如下,其中公布的適應癥中研究較多的為:中/重度急性呼吸窘迫綜合征、急性移植物抗宿主病、膝骨關節炎、慢加急性肝衰竭、間質性肺病。其中17個未公布適應癥為IND審評期間。
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。




 掃碼添加官方微信
掃碼添加官方微信